陳文達
最近,FDA授予百濟神州在zanubrutinib中抑制布魯頓酪氨酸激酶(BTK)的突破性療法,用于治療之前接受過至少一次治療的成人套細胞淋巴瘤(MCL)患者。2018年8月,中國國家醫藥產品監督管理局接受了zanubrutinib作為復發/難治性MCL患者潛在療法的新藥申請。
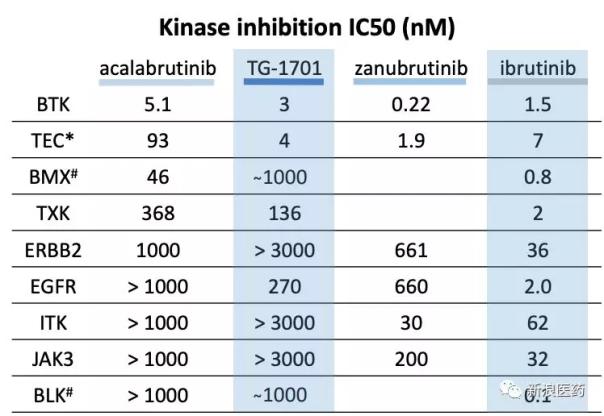
幾種BTK抑制劑的體外激酶活性比較
布魯頓蛋白激酶(Bruton protein kinase,BTK)是B細胞受體途徑的重要信號分子,在B淋巴細胞的各個發育階段均有表達,參與調節B細胞的增殖、分化和凋亡,在惡性B細胞的存活和擴散中起重要作用。
Ibrutinib是世界上第一個BTK抑制劑,它不僅抑制BTK,還抑制EGFR、JAK3、HER2等。它們是Tec家族的成員,導致出血風險、腹瀉、皮疹和其他副作用。Acalabrutinib是第二代不可逆BTK抑制劑,提高了BTK的選擇性,而對ITK和EGFR的抑制活性下降數百倍,對Tec的抑制活性下降十倍以上。Zanubrutinib也是第二代不可逆BTK抑制劑,BTK選擇性再次提高。從體外激酶活性的數據來看,zanubrutinib確實是研發后期BTK活性和選擇性最好的抑制劑。
Zanbrutinib臨床開發計劃

Zanubrutinib的全球開發計劃主要包括:比較伊布替尼用于WM,比較苯達莫司汀/利妥昔單抗用于CLL的初始治療,聯合GAZYVA(obinutuzumab)用于難治性復發性濾泡性淋巴瘤和B細胞血液腫瘤;在中國,單藥主要用于難治性和復發性MCL、難治性和復發性CLL/SLL、西醫、難治性和復發性彌漫性巨大B細胞淋巴瘤和B細胞血液腫瘤。
1、FDA授予突破性療法認定的MCL二線療法
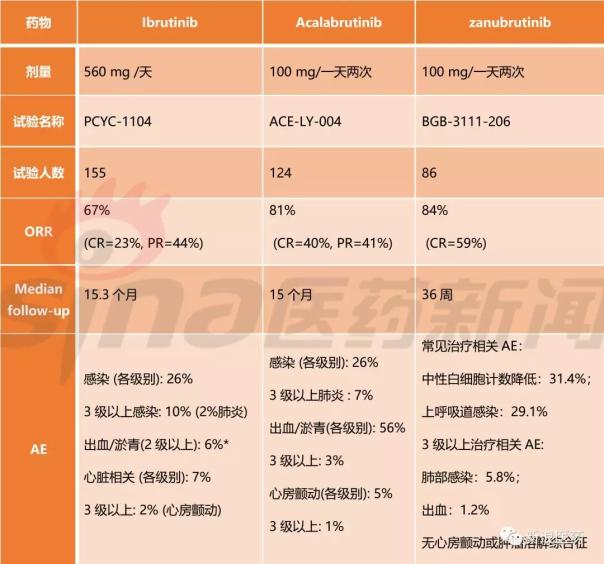
目前,批準用于該適應癥的兩種BTK抑制劑是Ibrutinib和Acalabrutinib。第一個批準的Ibrutinib的ORR最低,但它是一個經過三次治療后復發的中位患者。Acalabrutinib和Zanubrutinib在入組時相似,都是中位數兩次治療后復發的患者,ORR相似,但Zanubrutinib are率占優勢,3級以上不良反應率低。目前還沒有頭對頭的臨床試驗,無法證明哪種藥物更有效,但Zanubrutinib能被MCL批準上市應該是必然的。
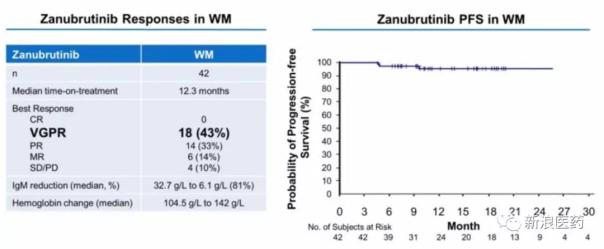
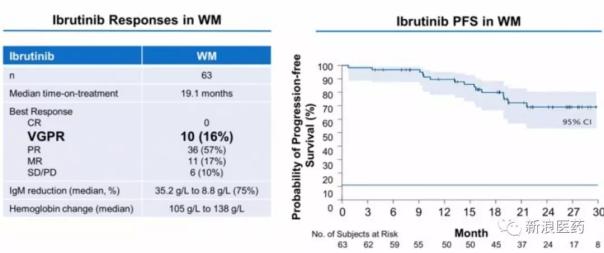
2、另一個進展較快的華氏巨球蛋白血癥(WM)
由于未成熟WM細胞的過度產生,WM患者抑制其他血細胞的產生。2015年1月,伊布替尼被FDA批準用于治療WM。基于I期試驗結果,Zanubrutinib于2018年7月獲得FDA對此適應癥的快速通道,并計劃通過快速審批于2019年初申請上市。與伊布替尼相比,良好部分緩解率(VGPR)和IgM降低率更高。
3、CLL才是要和ibrutinib爭奪的主要市場
讓我們來看看伊布替尼CLL的批準歷史。2014年2月,Imbruvica被批準用于在過去接受過至少一種治療的CLL成年患者。這是基于名為PCYC-1102的IB/2期試驗。ibrutinib作為單一藥物用于新診斷和難治性復發性慢性淋巴細胞白血病CLL/小淋巴細胞淋巴瘤SLL患者。然而,最終的批準是基于48名接受420毫克/天的CLL患者的結果。中位隨訪時間為15.6個月,有效率達58.3%,最長持續24.2個月。基于優良ORR的快速批準也為伊布替尼單藥的CLL活性奠定了基礎。
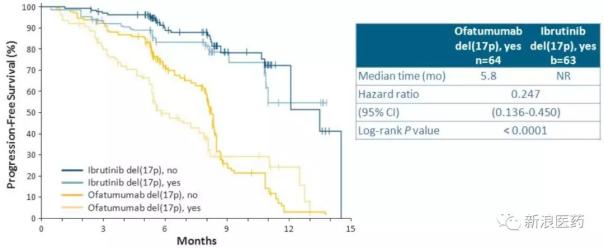
2014年7月,FDA批準其用于17號染色體(17p缺失)缺失的CLL成年患者。這一批準是基于對接受治療的CLL患者(包括那些有或沒有17p缺失的患者)的III期臨床試驗中,名為PCYC-1112 resonant的Ibrutinib 420mg/天與Arzerra(ofatumumab)的比較。試驗在中期分析時提前結束,與Arzerra組相比,ibrutinib組的PFS顯著增加(中位數為vs. 8.1個月,HR在127名17p缺失患者中,PFS也顯著改善(中位數為vs. 5.8個月,HR=0.247)。這一突破性療法獲得批準,確立了伊布替尼在CLL二線治療中的地位。61-83%的新診斷CLL患者攜帶17p缺失或P53突變,一些患者在治療復發后獲得17p缺失或p-53突變。Arzerra于2013年11月獲得FDA批準,通過突破性療法用于未經治療的CLL患者,這是第一個針對CLL的CD20單克隆抗體。但目前Arzerra作為一線治療標準一直在變,一直局限于難治性復發患者。
2016年3月被FDA批準用于CLL患者的一線治療。基于名為Resonate-2 (PCYC-1115)的Ibrutinib與Chlamybucil(苯丁酸氮芥)對65歲以上新診斷的CLL或SLL患者進行比較的III期臨床試驗,該試驗不包括17p缺失突變患者。
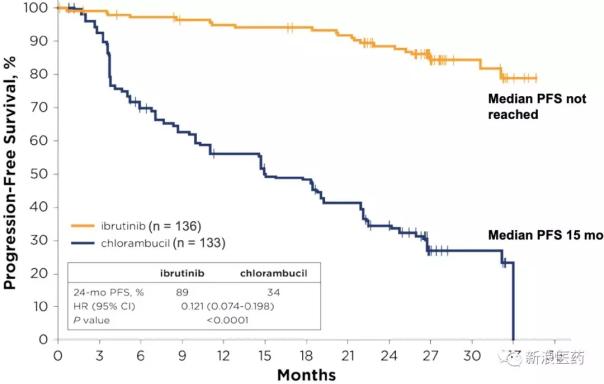
伊布替尼組患者的無進展生存期明顯長于苯丁酸氮芥組(伊布替尼組為18.9個月,苯丁酸氮芥組為18.9個月),疾病進展或死亡的風險為84%,低于苯丁酸氮芥組(HR=0.16)。Ibrutinib顯著延長了總存活時間。伊布替尼組患者的估計24個月生存率為98%,苯丁酸氮芥組患者的估計24個月生存率為85%。烏替尼組的死亡風險為84%,低于苯丁酸氮芥組(HR=0.16,P=0.001)。
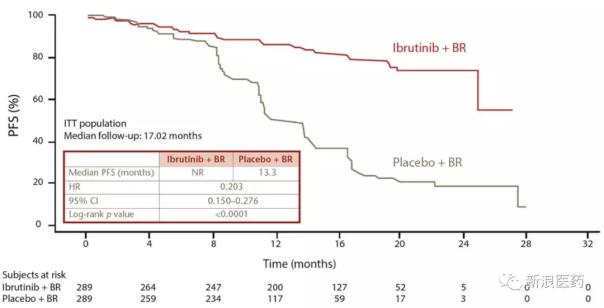
2016年5月,Imbruvica被批準與苯達莫司汀利妥昔單抗(BR)聯合用于治療成年CLL/SLL患者。根據名為HELIOS的批準試驗,與安慰劑BR治療組相比,Imbruvica BR三聯療法治療組顯著降低了80%的疾病進展或死亡風險(中位PFS小于13.3個月)。
2018年11月,Imbruvica提出了一項補充申請,用于治療之前未接受過治療的CLL/SLL成年患者,聯合使用羅氏抗癌藥Obinutuzumab (Otuzumab)。根據III期臨床研究的說明數據,與苯丁酸氮芥Obinutuzumab方案相比,Ibrutinib Obinutuzumab方案顯著延長了PFS,達到了研究的主要終點。
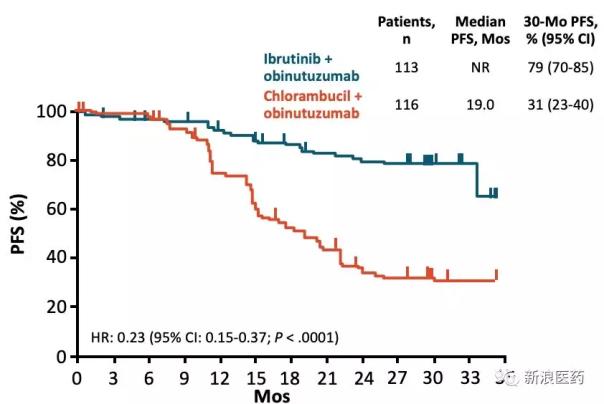
與zanubrutinib相比,人數與ibrutinib的PCYC-1102的IB/2試驗相當,但ORR明顯提高。雖然zanubrutinib在全球市場會比Acalabrutinib晚一步,但主要是先占領中國市場。
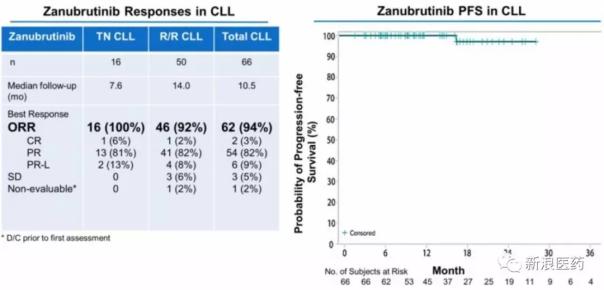
Zanubrutinib治療各種b細胞淋巴瘤的療效
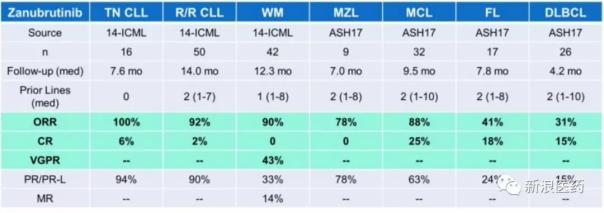
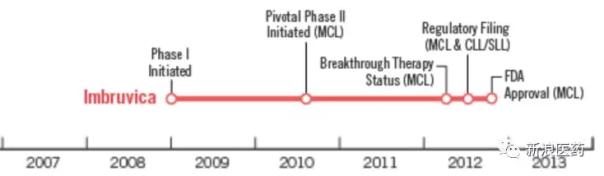
值得一提的是,Ibrutinib也在同年被認定為突破性療法。從一期試驗到FDA批準上市大概用了5年時間,希望盡快聽到Zanubrutinib的好消息。