35品面臨生死,要么破繭而出,要么被打回原形!
4月13日,美國食品藥品監(jiān)督管理局發(fā)布了《藥物臨床試驗數(shù)據自查核查注冊申請情況的公告(2017年第42號)》。
決定對新收到的35份已申報生產或進口進行臨床試驗的藥品注冊申請進行臨床試驗資料核查。在這份公告中,總局透露了憲法的三個章節(jié):
第一,藥企主動收回心虛,總局不會追究。在總局組織核查前,藥品注冊申請人通過自查發(fā)現(xiàn)藥物臨床試驗數(shù)據真實性的,應當主動撤回注冊申請,中國食品藥品監(jiān)督管理局將公布其名單,不追究其責任。
第二,10天公示期。總局審核檢查中心將在其網站上公示現(xiàn)場檢查計劃,并告知藥品注冊申請人和所在地省級食品藥品監(jiān)管部門。公示10個工作日,中心將告知現(xiàn)場檢查日期,不再受理藥品注冊申請人的撤回申請。
第三,嚴懲數(shù)據造假。中國食品藥品監(jiān)督管理局將對在藥物臨床試驗數(shù)據現(xiàn)場核查中發(fā)現(xiàn)弄虛作假的藥物臨床試驗申請人、負責人和管理者、合同研究機構負責人進行嚴肅處理,對未能有效履行職責的食品藥品監(jiān)管部門核查人員進行責任追究。
關于嚴懲臨床數(shù)據造假,4月10日,總局在《關于處理藥物臨床試驗數(shù)據核查有關問題的意見》征求意見稿中提到,已采納6條建議。
對涉及數(shù)據造假的品種,明確對相關人員的處理程序,調整向社會公布和列入黑名單的內容。對涉及數(shù)據造假的藥物臨床試驗機構,臨床試驗機構要限期整改,并調整到涉及的專業(yè)學科。
此次公布的35款產品中,哪些會主動退出,哪些會原形畢露,哪些會躍龍?等著瞧。
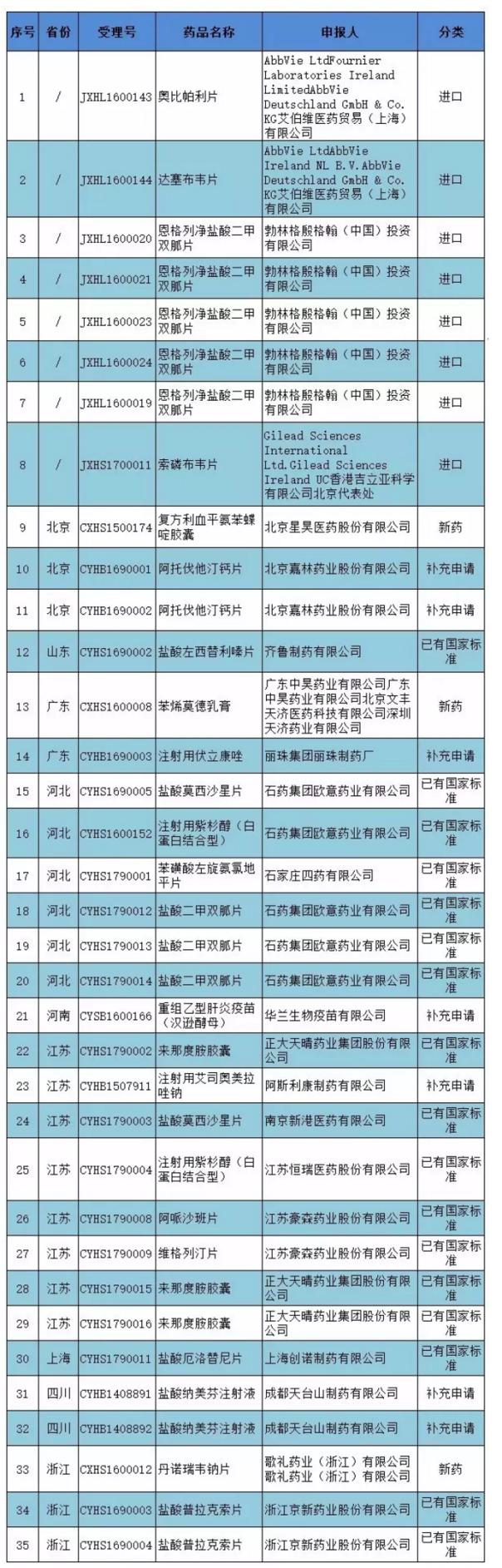
附件:35個藥物臨床試驗數(shù)據自查核查申請單。