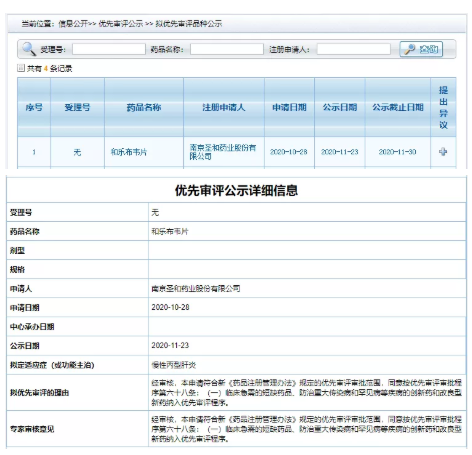
11月23日,CDE官網最新公告顯示,南京和盛藥業有限公司新藥“海樂布韋片”上市申請納入慢性丙型肝炎優先評價
和補胃片(R&D代號:SH229)是和盛自主研發的抗丙肝新藥。也是國內首個自主研發的NS5B抑制劑,肝靶向能力強,抗病毒活性高。臨床前結果顯示,SH229對基因型1-6 HCV的體外抗病毒活性比索非布韋高2-3倍。
2020年8月,在歐洲肝病學會(EASL)年會和數字世界肝病大會上介紹了中國HCV感染患者的II期臨床試驗(CTR20182539)。
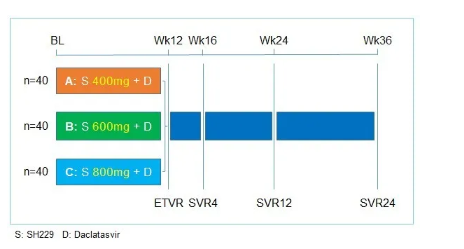
本次臨床試驗為II期臨床試驗,標簽為開發。將我國HCV感染患者按1:1:1的比例隨機分為三個隊列,分別接受60 mg達拉他韋聯合SH229 400 mg(隊列A)、600 mg(隊列B)或800 mg(隊列C)治療,每日1次,共12周。分層因素包括HCV基因型和肝硬化狀態。該研究的主要終點是治療結束后12周的病毒持續反應率(SVR12)。
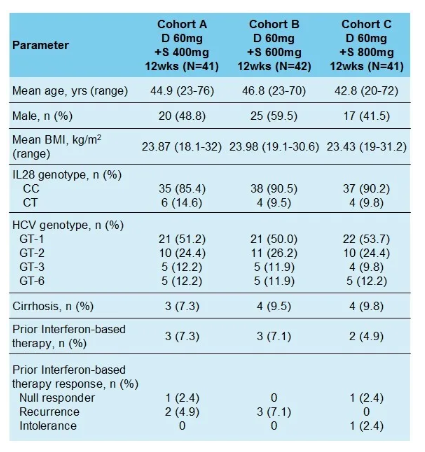
共有124名HCV感染患者參加了本研究,包括64名HCV 1型患者、31名HCV 2型患者、14名HCV 3型患者和15名HCV 6型患者。其中8.9%的患者在基線時有肝硬化,6.5%的患者在一線干擾素治療中失敗,88.7%的患者有IL28B CC等位基因。基線時所有患者的HCV RNA水平中位數為6.3 log10 IU/mL,50.8%患者的基線HCV RNA水平 200,000 IU/ml。
在SVR12評估的124例患者中,SH229治療的1/2型HCV感染患者的SVR12達到100%,難治性3/6型HCV感染患者也取得了良好的治療效果,其中6型HCV感染患者的SVR12達到93.3%。就安全性而言,所有患者耐受性良好,沒有因AE導致的治療相關SAE或停藥事件。
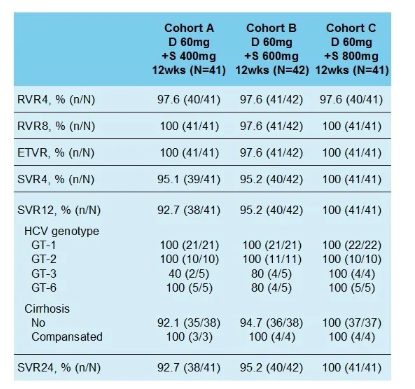
結論:SH229聯合達拉他韋治療中國泛基因型丙型肝炎患者療效顯著,且耐受性良好。